QUÍMICA TECNOLÓGICA
O equilíbrio da decomposição da amonia pode ser representado pela equação química, não balanceada:
NH3 (g) <==> N2 (g) + H2 (g)
As variações das concentrações com o tempo estão ilustradas no gráfico abaixo.
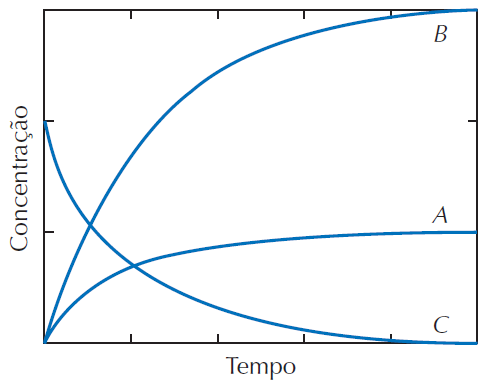
A partir da análise do gráfico, podemos afirmar que as curvas A, B e C representam a variação das concentrações dos seguintes componentes da reação, respectivamente:
H2, NH3 e N2
N2, H2 e NH3
H2, N2 e NH3
NH3, N2 e H2
NH3, H2 e N2
A tragédia ocorrida no município mineiro de Brumadinho (2019) não está restrita à perda de vidas que foram soterradas por milhares de toneladas de lama. A que se levar também em consideração, os efeitos ambientais contaminantes provocados por compostos presentes nesses rejeitos, que estarão presentes por décadas na vida das pessoas e animais da região. Entre esses compostos encontramos o cloreto de manganês (MnCl2) cuja intoxicação se manifesta por tremores, rigidez e problemas de coordenação, e o ácido arsênico (H3AsO4) que provoca nauseas, vomitos, diarréia, cancer de pele, podendo levar à morte. Analisando quimicamente as ligações existentes no cloreto de manganês e no ácido arsênico, podemos afirmar corretamente que:
O MnCl2 e o H3AsO4 são formados por ligações covalentes.
O MnCl2 é formado por ligações covalentes e o H3AsO4 é formado por ligação iônica.
O MnCl2 é formado por ligação metálica e o H3AsO4 é formado por ligações covalentes.
O MnCl2 é formado por ligação iônica e o H3AsO4 é formado por ligações covalentes.
O MnCl2 e o H3AsO4 são formado por ligações iônicas.
As ligações covalentes entre dois átomos podem ocorrer envolvendo 1 par de elétrons (ligação simples), 2 pares de elétrons (ligações duplas) ou 3 pares de elétrons (ligações triplas). Assinale a alternativa em que ambos os compostos apresentam ligações covalentes múltiplas (duplas ou triplas).
Dados: H (Z = 1); O (Z = 8); Cl (Z = 17); N (Z = 7); C (Z = 6); Al (Z = 13); K (Z = 19).
Cl2 e NH3.
Al Cl3 e KCl.
CO2 e N2.
H2O2 e HCl.
H2O e O2.
Várias leis estaduais de proteção ao meio ambiente proíbem que indústrias lancem nos rios efluentes residuais com pH menor que 5 ou superior a 8. Analisando os efluentes das indústrias A, B e C, que apresentam as seguintes concentrações (em mol/L) de H+ ou OH–, determine quais podem ser lançados diretamente em rios, sem tratamento prévio:
A: [H+] = 1,99 x 10-5
B: [H+] = 1,25 x 10-6
C: [H+] = 1,90 x 10-8
A e C.
A e B.
Somente A.
Somente C.
B e C
Considerando uma solução que apresenta concentração de H+ = 0,01 mol/L de um monoácido forte genérico HA e indique a alternativa correta.
[A-] = 0,1 mol / L.
O pH é igual a 1.
[HA] é muito maior que [A-].
O pH é maior que 1.
O pH é menor que 1.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
pH = 3
pH = 4
pH = 8
pH = 10
pH = 1
O hidróxido de sódio é um sólido iônico branco, altamente higroscópico. Sendo uma base muito forte, possui efeito altamente corrosivo sobre a pele. A fórmula quÃmica do hidróxido de sódio é __________ e, quanto à força podemos classifica-la como uma base _________ . Respectivamente, podemos completar corretamente a afirmação acima com:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:

H2, NH3 e N2
N2, H2 e NH3
H2, N2 e NH3
NH3, N2 e H2
NH3, H2 e N2
A tragédia ocorrida no município mineiro de Brumadinho (2019) não está restrita à perda de vidas que foram soterradas por milhares de toneladas de lama. A que se levar também em consideração, os efeitos ambientais contaminantes provocados por compostos presentes nesses rejeitos, que estarão presentes por décadas na vida das pessoas e animais da região. Entre esses compostos encontramos o cloreto de manganês (MnCl2) cuja intoxicação se manifesta por tremores, rigidez e problemas de coordenação, e o ácido arsênico (H3AsO4) que provoca nauseas, vomitos, diarréia, cancer de pele, podendo levar à morte. Analisando quimicamente as ligações existentes no cloreto de manganês e no ácido arsênico, podemos afirmar corretamente que:
O MnCl2 e o H3AsO4 são formados por ligações covalentes.
O MnCl2 é formado por ligações covalentes e o H3AsO4 é formado por ligação iônica.
O MnCl2 é formado por ligação metálica e o H3AsO4 é formado por ligações covalentes.
O MnCl2 é formado por ligação iônica e o H3AsO4 é formado por ligações covalentes.
O MnCl2 e o H3AsO4 são formado por ligações iônicas.
As ligações covalentes entre dois átomos podem ocorrer envolvendo 1 par de elétrons (ligação simples), 2 pares de elétrons (ligações duplas) ou 3 pares de elétrons (ligações triplas). Assinale a alternativa em que ambos os compostos apresentam ligações covalentes múltiplas (duplas ou triplas).
Dados: H (Z = 1); O (Z = 8); Cl (Z = 17); N (Z = 7); C (Z = 6); Al (Z = 13); K (Z = 19).
Cl2 e NH3.
Al Cl3 e KCl.
CO2 e N2.
H2O2 e HCl.
H2O e O2.
Várias leis estaduais de proteção ao meio ambiente proíbem que indústrias lancem nos rios efluentes residuais com pH menor que 5 ou superior a 8. Analisando os efluentes das indústrias A, B e C, que apresentam as seguintes concentrações (em mol/L) de H+ ou OH–, determine quais podem ser lançados diretamente em rios, sem tratamento prévio:
A: [H+] = 1,99 x 10-5
B: [H+] = 1,25 x 10-6
C: [H+] = 1,90 x 10-8
A e C.
A e B.
Somente A.
Somente C.
B e C
Considerando uma solução que apresenta concentração de H+ = 0,01 mol/L de um monoácido forte genérico HA e indique a alternativa correta.
[A-] = 0,1 mol / L.
O pH é igual a 1.
[HA] é muito maior que [A-].
O pH é maior que 1.
O pH é menor que 1.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
pH = 3
pH = 4
pH = 8
pH = 10
pH = 1
O hidróxido de sódio é um sólido iônico branco, altamente higroscópico. Sendo uma base muito forte, possui efeito altamente corrosivo sobre a pele. A fórmula quÃmica do hidróxido de sódio é __________ e, quanto à força podemos classifica-la como uma base _________ . Respectivamente, podemos completar corretamente a afirmação acima com:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
O MnCl2 e o H3AsO4 são formados por ligações covalentes.
O MnCl2 é formado por ligações covalentes e o H3AsO4 é formado por ligação iônica.
O MnCl2 é formado por ligação metálica e o H3AsO4 é formado por ligações covalentes.
O MnCl2 é formado por ligação iônica e o H3AsO4 é formado por ligações covalentes.
O MnCl2 e o H3AsO4 são formado por ligações iônicas.
As ligações covalentes entre dois átomos podem ocorrer envolvendo 1 par de elétrons (ligação simples), 2 pares de elétrons (ligações duplas) ou 3 pares de elétrons (ligações triplas). Assinale a alternativa em que ambos os compostos apresentam ligações covalentes múltiplas (duplas ou triplas).
Dados: H (Z = 1); O (Z = 8); Cl (Z = 17); N (Z = 7); C (Z = 6); Al (Z = 13); K (Z = 19).
Cl2 e NH3.
Al Cl3 e KCl.
CO2 e N2.
H2O2 e HCl.
H2O e O2.
Várias leis estaduais de proteção ao meio ambiente proíbem que indústrias lancem nos rios efluentes residuais com pH menor que 5 ou superior a 8. Analisando os efluentes das indústrias A, B e C, que apresentam as seguintes concentrações (em mol/L) de H+ ou OH–, determine quais podem ser lançados diretamente em rios, sem tratamento prévio:
A: [H+] = 1,99 x 10-5
B: [H+] = 1,25 x 10-6
C: [H+] = 1,90 x 10-8
A e C.
A e B.
Somente A.
Somente C.
B e C
Considerando uma solução que apresenta concentração de H+ = 0,01 mol/L de um monoácido forte genérico HA e indique a alternativa correta.
[A-] = 0,1 mol / L.
O pH é igual a 1.
[HA] é muito maior que [A-].
O pH é maior que 1.
O pH é menor que 1.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
pH = 3
pH = 4
pH = 8
pH = 10
pH = 1
O hidróxido de sódio é um sólido iônico branco, altamente higroscópico. Sendo uma base muito forte, possui efeito altamente corrosivo sobre a pele. A fórmula quÃmica do hidróxido de sódio é __________ e, quanto à força podemos classifica-la como uma base _________ . Respectivamente, podemos completar corretamente a afirmação acima com:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
Cl2 e NH3.
Al Cl3 e KCl.
CO2 e N2.
H2O2 e HCl.
H2O e O2.
Várias leis estaduais de proteção ao meio ambiente proíbem que indústrias lancem nos rios efluentes residuais com pH menor que 5 ou superior a 8. Analisando os efluentes das indústrias A, B e C, que apresentam as seguintes concentrações (em mol/L) de H+ ou OH–, determine quais podem ser lançados diretamente em rios, sem tratamento prévio:
A: [H+] = 1,99 x 10-5
B: [H+] = 1,25 x 10-6
C: [H+] = 1,90 x 10-8
A e C.
A e B.
Somente A.
Somente C.
B e C
Considerando uma solução que apresenta concentração de H+ = 0,01 mol/L de um monoácido forte genérico HA e indique a alternativa correta.
[A-] = 0,1 mol / L.
O pH é igual a 1.
[HA] é muito maior que [A-].
O pH é maior que 1.
O pH é menor que 1.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
pH = 3
pH = 4
pH = 8
pH = 10
pH = 1
O hidróxido de sódio é um sólido iônico branco, altamente higroscópico. Sendo uma base muito forte, possui efeito altamente corrosivo sobre a pele. A fórmula quÃmica do hidróxido de sódio é __________ e, quanto à força podemos classifica-la como uma base _________ . Respectivamente, podemos completar corretamente a afirmação acima com:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
A e C.
A e B.
Somente A.
Somente C.
B e C
Considerando uma solução que apresenta concentração de H+ = 0,01 mol/L de um monoácido forte genérico HA e indique a alternativa correta.
[A-] = 0,1 mol / L.
O pH é igual a 1.
[HA] é muito maior que [A-].
O pH é maior que 1.
O pH é menor que 1.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
pH = 3
pH = 4
pH = 8
pH = 10
pH = 1
O hidróxido de sódio é um sólido iônico branco, altamente higroscópico. Sendo uma base muito forte, possui efeito altamente corrosivo sobre a pele. A fórmula quÃmica do hidróxido de sódio é __________ e, quanto à força podemos classifica-la como uma base _________ . Respectivamente, podemos completar corretamente a afirmação acima com:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
[A-] = 0,1 mol / L.
O pH é igual a 1.
[HA] é muito maior que [A-].
O pH é maior que 1.
O pH é menor que 1.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
pH = 3
pH = 4
pH = 8
pH = 10
pH = 1
O hidróxido de sódio é um sólido iônico branco, altamente higroscópico. Sendo uma base muito forte, possui efeito altamente corrosivo sobre a pele. A fórmula quÃmica do hidróxido de sódio é __________ e, quanto à força podemos classifica-la como uma base _________ . Respectivamente, podemos completar corretamente a afirmação acima com:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
pH = 3
pH = 4
pH = 8
pH = 10
pH = 1
O hidróxido de sódio é um sólido iônico branco, altamente higroscópico. Sendo uma base muito forte, possui efeito altamente corrosivo sobre a pele. A fórmula quÃmica do hidróxido de sódio é __________ e, quanto à força podemos classifica-la como uma base _________ . Respectivamente, podemos completar corretamente a afirmação acima com:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
HCl ; fraca.
NaOH ; moderada.
NaOH ; forte.
NaOH ; fraca.
HCl ; forte.
O uso das rochas ornamentais como revestimentos na construção civil tem crescido muito nos últimos anos. O mármore, uma rocha muito utilizada, é basicamente formado de carbonato de cálcio (CaCO3). O carbonato de cálcio pertence a função química inorgânica dos Sais e pode ser formado por reação de neutralização entre um ácido e uma base. Qual das alternativas abaixo representa a reação correta que dará origem a este sal?
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
Ca(OH)2 + H2CO3 ---->
H2CO3 + H3PO4 ---->
2 NaOH + H2SO4 ---->
2 CaOH + HNO3 ---->
CaCO3 + H2CO ---->
Geralmente o inicio da corrosão do metal contido no concreto armado, se da nos primeiros dias de sua confecção através da carbonatação do concreto. A presença de hidróxido de cálcio [Ca(OH)2] liberado das reações de hidratação do cimento, em reagindo com ácido carbônico (H2CO3) , formado à partir da união de anidrido carbônico (CO2) e água (H2O), provoca o aparecimento de trincas. A reação de neutralização ocorrida entre o ácido carbônico e o hidróxido de cálcio é:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O
O gás natural (CH4), é produzido pela decomposição de compostos orgânicos, na ausência de oxigênio, por determinadas bactérias. Sua combustão pode ser representada pela reação abaixo:
CH4(g) + 2 O2(g) ----> CO2(g) + 2 H2O(vapor)
Quando nessa combustão, são consumidos 3 mols de oxigênio, o número de mols de gás carbônico (CO2) liberados será igual a:
H2CO3 + 2 CaOH ----> Ca2CO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaCO3 + H2(OH)2
H2CO3 + Ca(OH)2 ----> CaCO3 + 2 H2O
H2CO3 + Ca(OH)2 ----> CaH4 + 2 CO4
H2CO2 + Ca(OH)2 ----> CaCO2 + 2 H2O